
Un peu d’histoire
La perte de la pulpe crée dans le canal radiculaire un espace vide qui doit être comblé. Le traitement du canal radiculaire existe depuis longtemps déjà et la méthode a peu évolué au cours des années. La technique utilisée au départ consistait à poser un cône unique solide de gutta-percha avec un sealer. Elle a par la suite évoluée vers la condensation latérale et le compactage vertical à chaud pour obtenir une obturation tridimensionnelle (1). Le cône sert de fouloir pour répartir le sealer liquide, combler les espaces vides, humidifier la paroi dentinaire préparée et y adhérer. C’est le sealer qui entre en contact avec la dentine et le tissu parodontal. Il doit donc posséder les propriétés idéales, comme décrit par Grossman (2).
Les trois fonctions essentielles d’une obturation canalaire sont le scellement contre l’invasion bactérienne provenant de la cavité buccale, la destruction des microorganismes restants et l’obturation hermétique au niveau microscopique pour empêcher le fluide stagnant de s’accumuler et de servir de nutriments aux bactéries (3). La technique de condensation à chaud par gutta-percha combinée aux sealers adéquats a fait ses preuves dans ce domaine, car elle garantit une obturation hermétique par l’interaction avec la paroi dentinaire et la formation de « bouchons de sealer ». Les sealers à base de résine époxy s’avèrent être les plus adaptés ici et offrent la meilleure obturation hermétique.
L ’obturation par hydro-filler
BioRoot™ RCS (Septodont, Saint-Maur-des-Fossés, Frankrijk) is een hydro cement bestaande uit een poeder van tricalciumsilicaat en zirkoniumoxide, en een vloeistof die voornamelijk water bevat met toevoeging van calciumchloride en een waterop losbaar polymeer. Deze additieven dienen om de fysische eigenschappen van het materiaal te verbeteren. Deze samenstelling zorgt voor de specifieke eigenschappen die hierna beschreven worden.
Lage concentratie sporenelementen
De meeste materialen op basis van tricalciumsilicaat bestaan uit Portland cement. Portland cement wordt gebruikt in de bouwnijverheid en bestaat uit natuurlijke mineralen. Om kosten te besparen wordt een secundaire brandstof, meestal een reststof, gebruikt om de cement te ‘branden’. Met als resultaat het insluiten van sporenelementen die oplossen als ze klinisch gebruikt worden (4-6).
BioRoot™ RCS is de enige cement uit puur trical-ciumsilicaat zonder toevoegingen (Tabel 1), dus zonder sporenelementen en met het zuivere trical-ciumsilicaat als actief agens. Portland cement bevat slechts 68% tricalciumsilicaat (7). Alle specifieke eigenschappen van het tricalciumsilicaat zoals de vorming van calciumhydroxide voor de biomineralisatie en vorming van bot en hard weefsel, en de antimicrobiële eigenschappen zijn dus minder aanwezig bij Portland cement. BioRoot™ RCS stelt zelfs dubbel zoveel calciumionen vrij als Endosequence BC en tien maal meer dan MTA Fillapex (Tabel 2), in dezelfde tijdspanne en onder dezelfde condities (8).
Men testte drie producten op basis van Portland cement, nl. MTA Angelus, MTA Fillapex en Theracal LC op in-vivo modellen, om te zien of hun aanwezigheid in extractie-alveolen het aluminium niveau in het plasma en de lever zou beïnvloeden. En men vond er inderdaad sporen van aluminium (9). Bovendien vond men een aluminiumpiek in het hersenweefsel van proefdieren nadat het 7 dagen in MTA Angelus was ingebed, en na 60 dagen in Theracal en MTA Fillapex. Er werd een oxidatieve stress geinduceerd en een tijdelijke toename van antioxiderende enzymen (10). Hoge concentraties aluminium in contact met menselijk weefsel werd gelinkt aan de ziekte van Alzheimer (11).
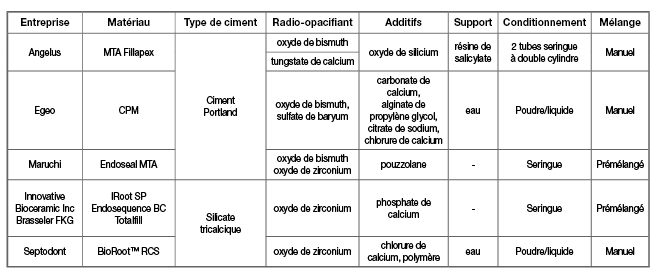
Tableau 1 : Sealers à base de silicate tricalcique disponibles sur le marché.
L’utilisation d’un radio-opacifiant inerte
BioRoot™ RCS contient de l’oxyde de zirconium comme opacifiant. Cet oxyde de zirconium est stable (tableau 2) et apporte l’opacité nécessaire au matériau (Figure 1) (8), laquelle est conservée en cas d’application clinique. BioRoot™ RCS est facile à détecter sur une radiographie postopératoire, ce qui permet d’évaluer correctement l’obturation. BioRoot™ RCS n’utilise pas d’oxyde de bismuth comme radio-opacifiant. Ce dernier provoque en effet une décoloration dentaire quand il est en contact avec l’hypochlorite de sodium (12) qui est utilisé en endodontie comme solution d’irrigation.
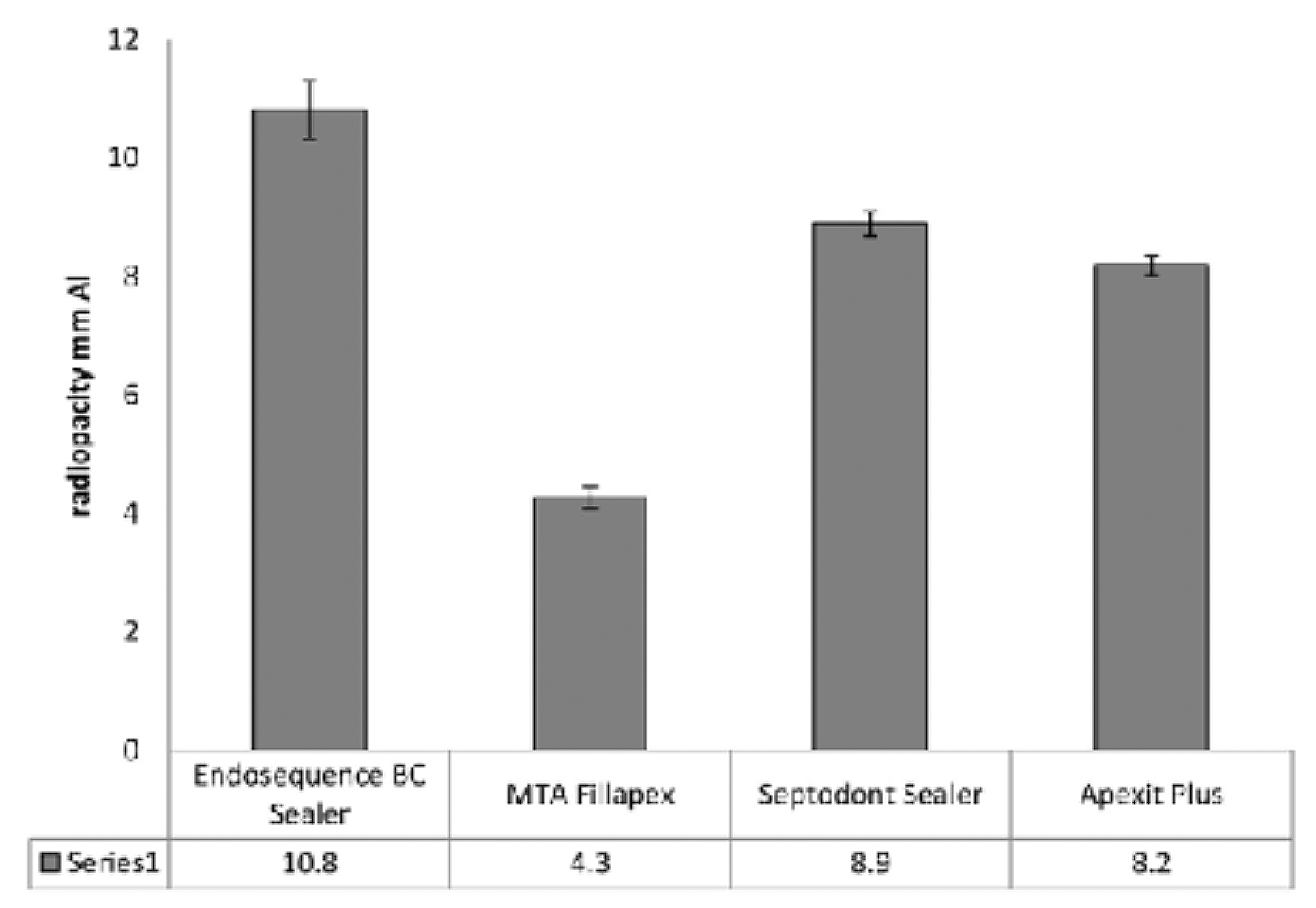 |
Fig. 1 : Radio-opacité des différents sealers. (Septodont Sealer correspond à BioRoot™ RCS). Reproduit avec l’autorisation de Xuereb et al. 2015. |
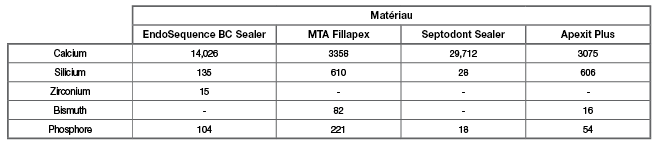
Tableau 2 : Éléments lixiviés dans du sérum physiologique de différents hydro-sealers. (Septodont Sealer correspond à BioRoot™ RCS). Reproduit avec l’autorisation de Xuereb et al. 2015.
De bonnes propriétés antibactériennes
Le succès d’un traitement endodontique repose sur l’élimination microbienne et la prévention de la recolonisation bactérienne du canal radiculaire. En solution, BioRoot™ RCS libère de hautes concentrations de calcium (tableau 2), ce qui conduit à un pH élevé. Il possède d’excellentes propriétés antimicrobiennes, comme en témoigne l’élimination des microorganismes dans les tubules dentinaires (Figure 2). Cette élimination est tout aussi efficace quand on utilise de l’eau comme solution d’irrigation (12), et son efficacité augmente encore quand on utilise de l’EDTA.
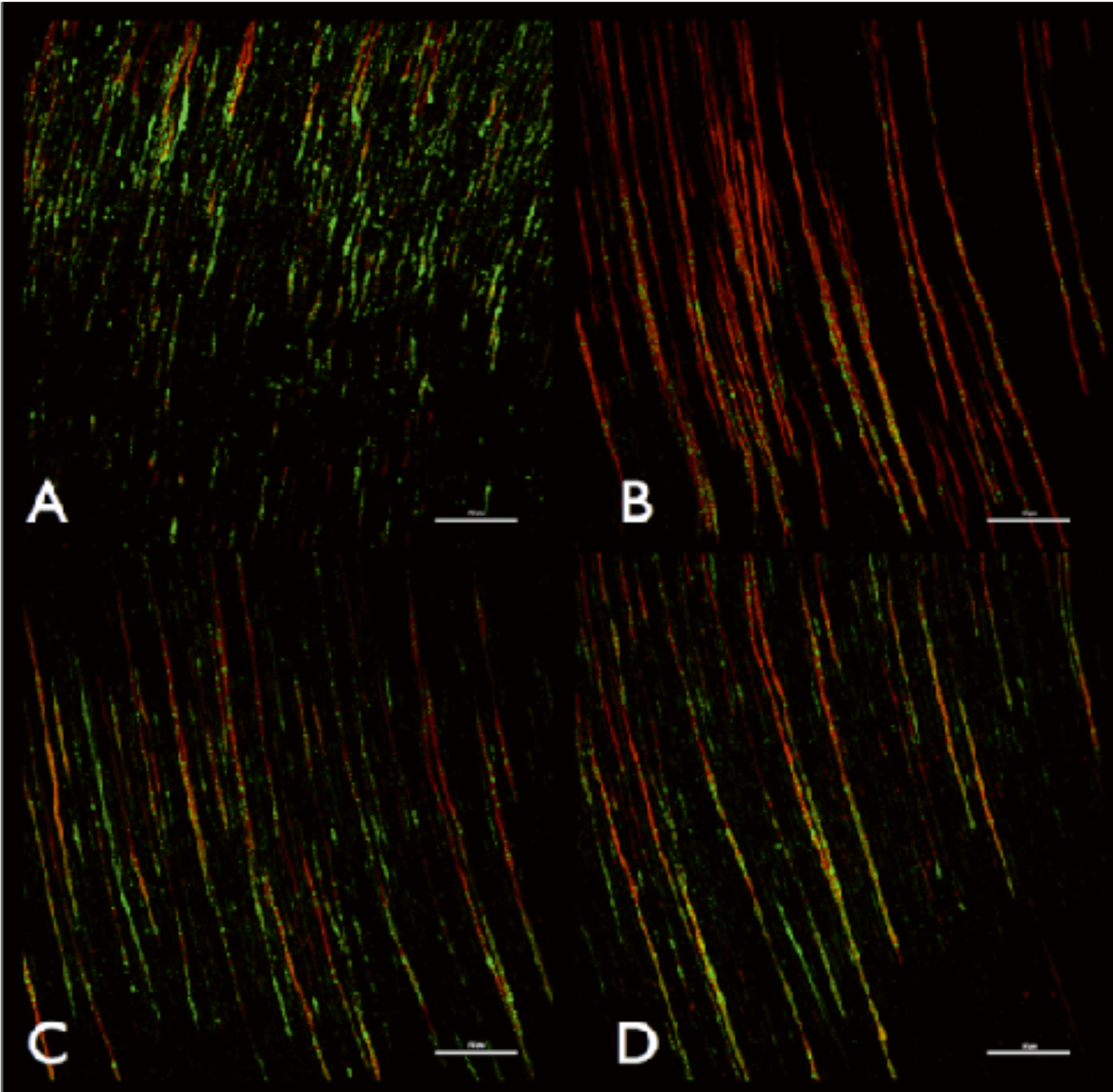 |
Fig. 2: Images microscopiques représentatives d’un scanner laser confocal du (A) groupe de contrôle irrigué avec EDTA, (B) BioRoot™ RCS après EDTA, (C) MTA Fillapex après EDTA et (D) AH Plus après EDTA. Les petites lignes représentent 50 mm. La couleur rouge indique des microbes morts. Reproduit avec l’autorisation d’Arias Moliz & Camilleri 2016. |
Scellement biologique
BioRoot™ RCS interagit avec la paroi dentinaire du canal radiculaire et forme une couche hybride riche en minéraux (Figure 3). Il s’avère que BioRoot™ RCS se lie chimiquement, contrairement à la liaison de nature mécanique des sealers à base de résine (13). Cette force d’adhérence augmente la stabilité.
Combinées à une action antimicrobienne efficace, ces caractéristiques en font le sealer le mieux adapté du marché. BioRoot™ RCS est bien toléré par le tissu parodontal (14-16) et toute extrusion ne discrédite en rien la réussite clinique.
Méthode d’obturation
BioRoot™ RCS doit être utilisé de préférence avec des techniques d’obturation à froid. Dans le cas de la technique à chaud, l’eau chaude s’évaporerait du sealer, ce qui modifierait la fluidité et l’épaisseur du matériau (17). Il a récemment été démontré que la technique du cône unique est recommandée dans le cas des hydro-sealers. La pénétration dans les tubules dentinaires ne dépend pas de la technique utilisée (18,19). Si l’on utilise un cône calibré avec le diamètre du canal radiculaire préparé, la technique du cône unique à froid donnera d’aussi bons résultats que la technique de condensation verticale à chaud (20).
Il s’avère aussi que la procédure de retraitement de BioRoot™ RCS utilisé en combinaison avec une seule pointe de gutta-percha est plus aisée, en comparaison avec AH Plus : on a observé moins de résidus de sealer et des temps de traitement plus courts (21).
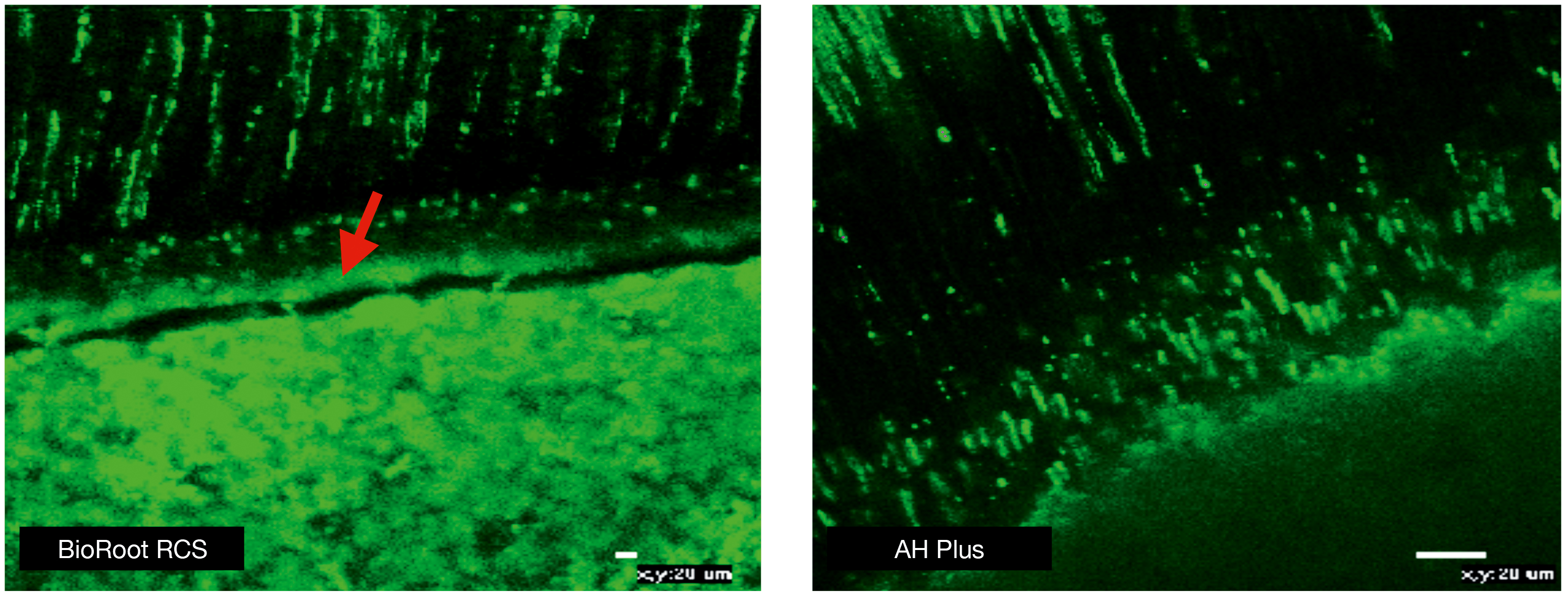
Fig 3: Les caractéristiques d’interface de BioRoot™ RCS montrent une couche riche en minéraux (voir flèche) avec des bouchons de sealer, contrairement à AH Plus qui ne présente que des bouchons de sealer. Le matériau mélangé à la fluorescéine, rendu visible sous microscopie laser confocale avec une longueur d’onde excitation/émission de 494/518 nm. Reproduit avec l’autorisation de Viapiana et al. 2016.
Conclusion
BioRoot™ RCS est un hydro-sealer qui permet une obturation aisée et efficace du canal radiculaire. Le matériau n’est pas toxique et peut être utilisé avec de solides pointes de gutta dans la technique du cône unique à froid : une technique d’obturation simple et peu coûteuse, car elle requiert un matériau moins sophistiqué. La réussite de l’obturation réside dans l’action antimicrobienne et le scellement biol-gique, contrairement au scellement hermétique rapporté pour les autres produits. BioRoot™ RCS peut être davantage considéré comme un matériau de comblement utilisé en
Biografie
 |
Josette Camilleri B.Ch.D., M.Phil., Ph.D., FICD, FADM, FIMMM, FHEA (UK) School of Dentistry, |
|
|
|
Biography
Professor Josette Camilleri obtained her Bachelor of Dental Surgery and Master of Philosophy in Dental Surgery from the University of Malta. She completed her doctoral degree, supervised by the late Professor Tom Pitt Ford, at Guy’s Hospital, King’s College London.
She has worked at the Department of Civil and Structural Engineering, Faculty for the Built Environment, University of Malta and at the Department of Restorative Dentistry, Faculty of Dental Surgery, University of Malta. She is currently a senior academic at the School of Dentistry, University of Birmingham, U.K. Her research interests include endodontic materials such as root-end filling materials and root canal sealers, with particular interest in mineral trioxide aggregate, Portland cement hydration and other cementitious materials used as biomaterials and also in the construction industry.
Josette has published over 100 papers in peer-reviewed international journals and her work is cited over 4000 times. She is the Editor of “Mineral trioxide aggregate. From preparation to application” published by Springer in 2014. She is a contributing author to the 7th edition of “Harty’s Endodontics in Clinical Practice” (Editor: BS Chong) and “Glass ionomer cements in Dentistry” (Editor: SK Sidhu). She is an international lecturer, a reviewer and a member of the scientific panel of a number of international journals including the Journal of Endodontics, Scientific Reports, Dental Materials, Clinical Oral Investigation, Journal of Dentistry, Acta Odontologica Scandinavica and Acta Biomaterialia.
Referenties
- Schilder H. Filling root canals in three dimensions. Dent Clin North Am. 1967.
- Grossman LI. Endodontic Practice. Philadelphia: Lea & Febiger.1978
- Sundqvist G, Figdor D. Endodontic treatment of apical periodontitis. In: Ørstavik D, Pitt Ford TR, eds. Essential Endodontology. Prevention and Treatment of Apical Periodontitis. Oxford: Blackwell, 1998.
- Schembri M, Peplow G, Camilleri J. Analyses of heavy metals in mineral trioxide aggregate and Portland cement. J Endod. 2010;36(7):1210-5.
- Chang SW, Shon WJ, Lee W, Kum KY, Baek SH, Bae KS. Analysis of heavy metal contents in gray and white MTA and 2 kinds of Portland cement: a preliminary study. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 2010;109(4):642-6.
- Monteiro Bramante C, Demarchi AC, de Moraes IG, Bernadineli N, Garcia RB, Spångberg LS, Duarte MA. Presence of arsenic in different types of MTA and white and gray Portland cement.Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 2008;106(6):909-13.
- Camilleri J. Characterization and hydration kinetics of tricalcium silicate cement for use as a dental biomaterial. Dent Mater. 2011;27(8):836-44.
- Xuereb M, Vella P, Damidot D, Sammut CV, Camilleri J. In situ assessment of the setting of tricalcium silicate-based sealers using a dentin pressure model. J Endod. 2015;41(1):111-24.
- Demirkaya K, Can Demirdöğen B, Öncel Torun Z, Erdem O, Çetinkaya S, Akay C (2016). In vivo evaluation of the effects of hydraulic calcium silicate dental cements on plasma and liver aluminium levels in rats. Eur J Oral Sci. 124(1):75-81.
- Demirkaya K, Demirdöğen BC, Torun ZÖ, Erdem O, Çırak E, Tunca YM (2016). Brain aluminium accumulation and oxidative stress in the presence of calcium silicate dental cements. Hum Exp Toxicol. pii: 0960327116679713.
- Forbes WF, Gentleman JF. Risk factors, causality, and policy initiatives: the case of aluminum and mental impairment. Exp Gerontol 1998:33:141–54.
- Arias-Moliz MT, Camilleri J. The effect of the final irrigant on the antimicrobial activity of root canal sealers. J Dent. 2016;52:30-6.
- Viapiana R, Moinzadeh AT, Camilleri L, Wesselink PR, Tanomaru Filho M, Camilleri J. Porosity and sealing ability of root fillings with gutta-percha and BioRoot™ RCS or AH Plus sealers. Evaluation by three ex vivo methods. Int Endod J. 2016;49(8):774-82.
- Collado-González M, García-Bernal D, Oñate-Sánchez RE, Ortolani-Seltenerich PS, Lozano A, Forner L, Elena C, Rodríguez-Lozano FJ. Biocompatibility of three new calcium silicate-based endodontic sealers on human periodontal ligament stem cells. Int Endod J. 2016 Sep 26. doi: 10.1111/iej.12703. [Epub ahead of print].
- Poggio C, Riva P, Chiesa M, Colombo M, Pietrocola G. Comparative cytotoxicity evaluation of eight root canal sealers. J Clin Exp Dent. 2017;1;9(4):e574-e578.
- Camps J, Jeanneau C, El Ayachi I, Laurent P, About I. Bioactivity of a Calcium Silicate- based Endodontic Cement (BioRoot™ RCS): Interactions with Human Periodontal Ligament Cells In Vitro. J Endod. 2015;41(9):1469-73.
- Camilleri J. Sealers and warm gutta-percha obturation techniques. J Endod. 2015;41(1):72-8.
- Jeong JW, DeGraft-Johnson A, Dorn SO, Di Fiore PM. Dentinal Tubule Penetration of a Calcium Silicate-based Root Canal Sealer with Different Obturation Methods. J Endod. 2017;43(4):633-637.
- McMichael GE, Primus CM, Opperman LA. Dentinal Tubule Penetration of Tricalcium Silicate Sealers. J Endod. 2016;42(4):632-6.
- Alshehri M, Alamri HM, Alshwaimi E, Kujan O. Micro-computed tomographic assessment of quality of obturation in the apical third with continuous wave vertical compaction and single match taper sized cone obturation techniques. Scanning. 2016;38(4):352-6.
- Donnermeyer D, Bunne C, Schäfer E, Dammaschke T. Retreatability of three calcium silicate-containing sealers and one epoxy resin-based root canal sealer with four different root canal instruments. Clin Oral Investig. 2017 Jun 22. doi: 10.1007/ s00784-017-2156-5. [Epub ahead of print]
